目前,临床上尚缺乏可以用于卵巢癌无创诊断且性能优异的生物标志物。近日,北京协和医院临床研究团队与思路迪研究团队合作发现血清来源的小胞外囊泡 (sEV) microRNA (miRNA)在良性和卵巢癌恶性鉴别方面具有良好性能,尤其在I期卵巢癌与良性患者的区分上优于血清CA125,助力卵巢癌早诊。此外,还发现血清sEV miRNA可预测卵巢癌患者预后。研究成果在线发表于国际纳米领域顶级期刊ACS Nano(IF=17.1)。这是基于思路迪自主研发的外泌体底层技术开展多种恶性肿瘤早诊探索,并在《Journal of Extracellular Vesicles》(IF=16.0)(血浆外泌体miRNA助力肺癌早诊)、《Journal of Nanobiotechnology》(IF=10.2)(血浆外泌体miRNA区分不确定性肺结节)和《Clinical and Translational Medicine》(IF=10.6)(新的生物标志物助力胰腺癌早诊)发表多个外泌体在肺癌和胰腺癌早诊中研究成果之后,思路迪联合临床专家又一次在肿瘤早诊研究中取得突破。

卵巢癌是一种严重威胁女性生命健康的妇科癌症,约90%原发性卵巢癌属于上皮性卵巢癌。临床上,常提到卵巢癌三个残酷的“70%”:70%的卵巢癌患者就诊时已是晚期;70%的卵巢癌患者初始治疗后三年内会复发;70%的晚期卵巢癌患者生存时间不超过五年。因此,准确、及时地诊断卵巢癌对临床干预至关重要。传统血清生物标志物CA125和HE4的敏感性和灵敏度尚无法满足卵巢癌临床诊断的需求。本研究探索血清来源的sEV miRNA作为区分卵巢良恶性肿块并预测卵巢癌患者预后潜在生物标志物的可能性。研究结果表明基于sEV miRNA的模型(sEVmiR-EOC)在卵巢癌诊断和患者预后预测方面性能优异。
本研究已在ClinicalTrials.gov注册(注册号为 NCT03738319), 入组患者均签署知情同意书。本项目研究患者入组排除条件包括:(1)非上皮亚型;(2)非初诊复发病例;(3)卵巢交界性肿瘤。所有样本病理诊断均严格参照2014年世界卫生组织(WHO)女性生殖器官肿瘤分类的手术切除组织切片鉴定标准。三个队列患者的划分是基于招募时间,即2019年1月至2019年11月期间招募的患者被分为训练队列, 2019 年 12 月至 2020 年 6 月期间招募的患者被分为测试队列,2020 年 7 月至 2020 年 10 月期间招募的患者被分为验证队列。
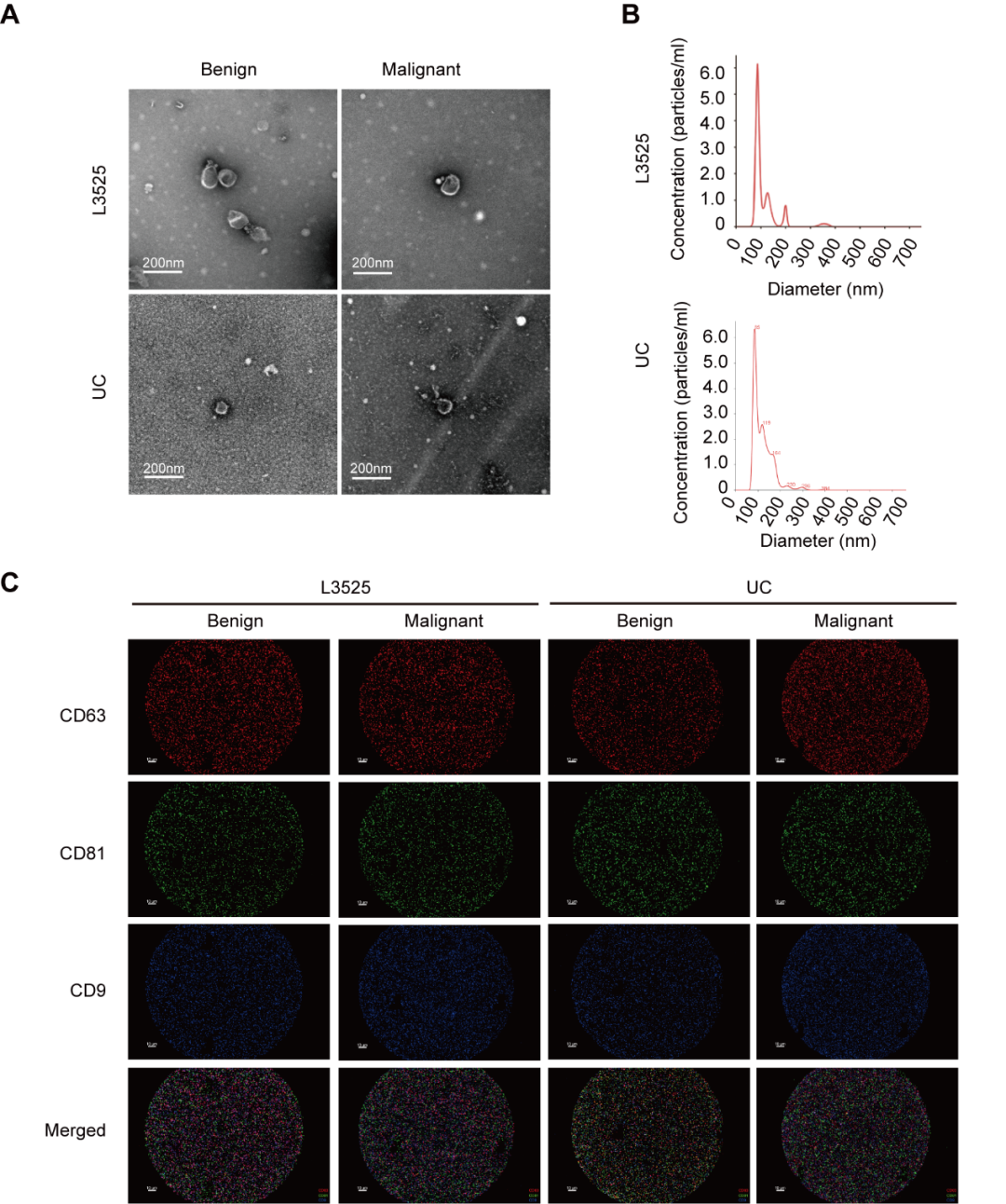
本研究使用思路迪自主研发的外泌体分离试剂进行血清sEVs提取。基于透射电子显微镜(TEM)、纳米粒子跟踪分析(NTA)和外泌体表面标志物荧光检测分析结果均表明,思路迪自主研发的外泌体分离试剂与超速离心法(UC)提取的血清sEV特征一致(图1)。
图 1. 血清来源 sEV 的特征检测 (A) 血清sEVs TEM检测结果;(B) 血清sEVs NTA分析结果;(C) 血清sEVs表面标志物荧光检测分析结果
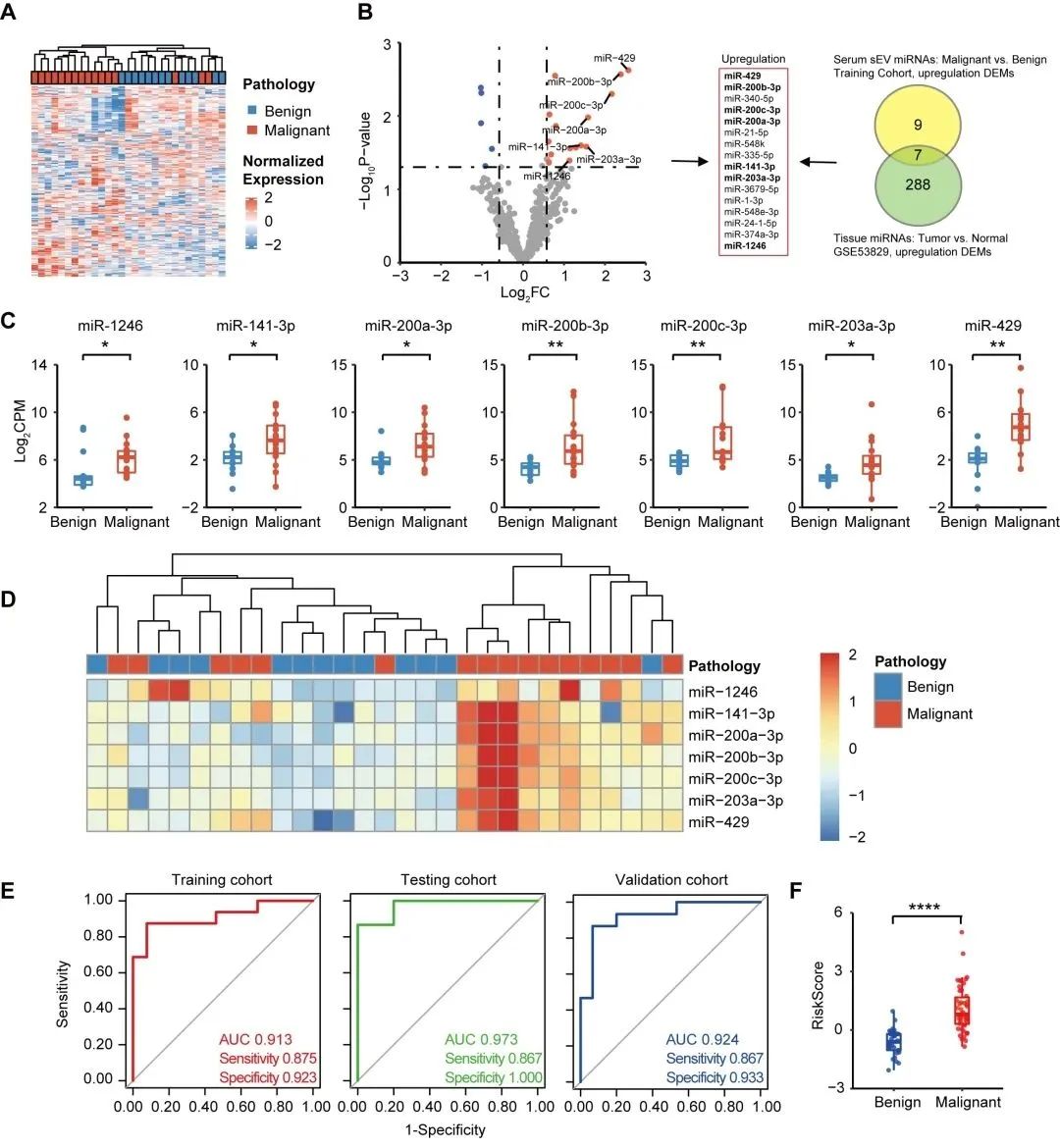
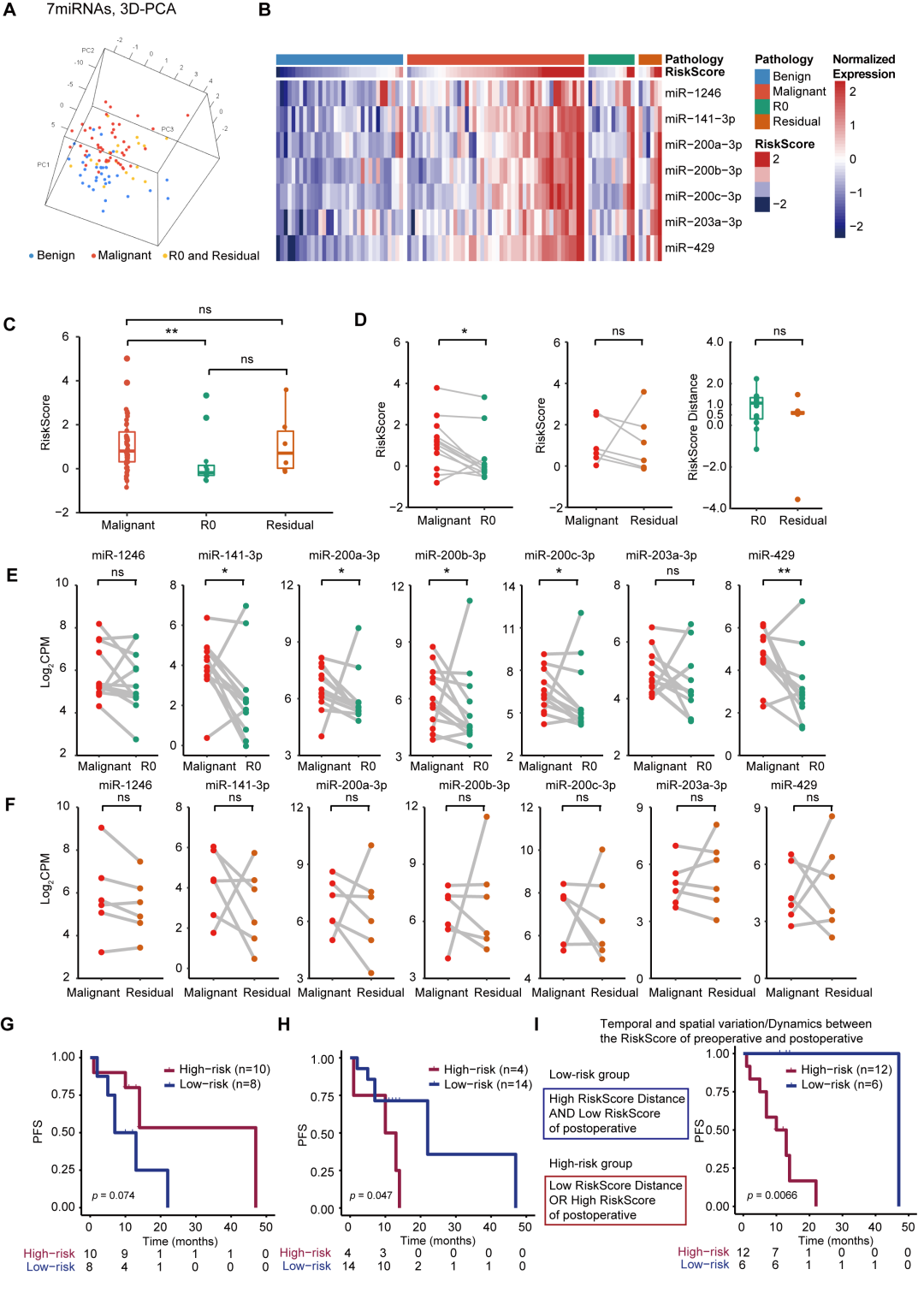
通过对良性与卵巢癌患者血清sEV miRNA差异表达分析,并整合组织 miRNA 数据库(GSE53829)分析后,最终聚焦七个血清 sEV DEMs(miR-1246、miR-141-3p、miR-200a-3p、miR-200b-3p、miR-200c-3p、miR-203a-3p 和 miR-429)用于sEVmiR-EOC建模(图2A-D)。研究结果显示,sEVmiR-EOC模型在训练队列中鉴别良性和卵巢癌患者性能优异,且在测试队列和验证队列中被进一步确认(图2E)。进一步分析发现,良恶性患者间sEVmiR-EOC模型的风险评分存在显著差异(图2F)。
图 2. 识别卵巢癌sEVmiR-EOC模型的构建和验证 (A) 训练队列良恶性患者血清 sEV miRNA的无监督聚类分析;(B) 训练队列良性和卵巢癌患者DEM展示;(C) 七个sEV miRNAs在良恶性患者间差异表达;(D) 训练队列中七个sEV miRNAs无监督聚类分析;(E) 在训练队列、测试队列和验证队列中sEVmiR-EOC模型的ROC曲线; (F) 良恶性患者间sEVmiR-EOC模型的风险评分比较
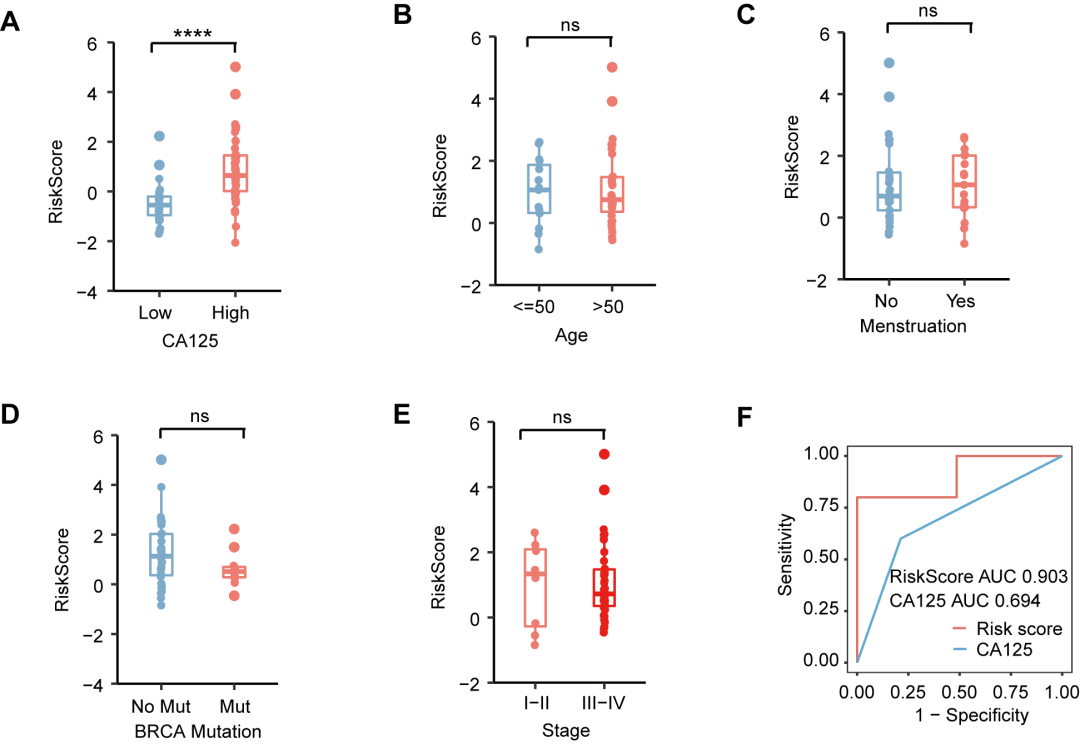
基于多种临床特征与sEVmiR-EOC模型风险评分关联分析结果显示,sEVmiR-EOC模型风险评分高的患者组血清CA125水平显著升高(图3A)。然而,sEVmiR-EOC模型风险评分不受年龄、月经、BRCA突变和肿瘤分期的影响(图3B-E)。同时,基于sEVmiR-EOC模型风险评分对I期卵巢癌患者的诊断性能优于传统血清CA125(图3F)。
图 3. 基于临床特征的风险评分关联分析 (A) CA125表达水平、(B) 年龄、(C) 月经情况、(D) BRCA 突变状态以及(E)肿瘤分期与sEVmiR-EOC模型风险评分间关联分析;(F) 基于sEVmiR-EOC模型RiskScore或血清CA125表达水平对于I期卵巢癌诊断的ROC曲线
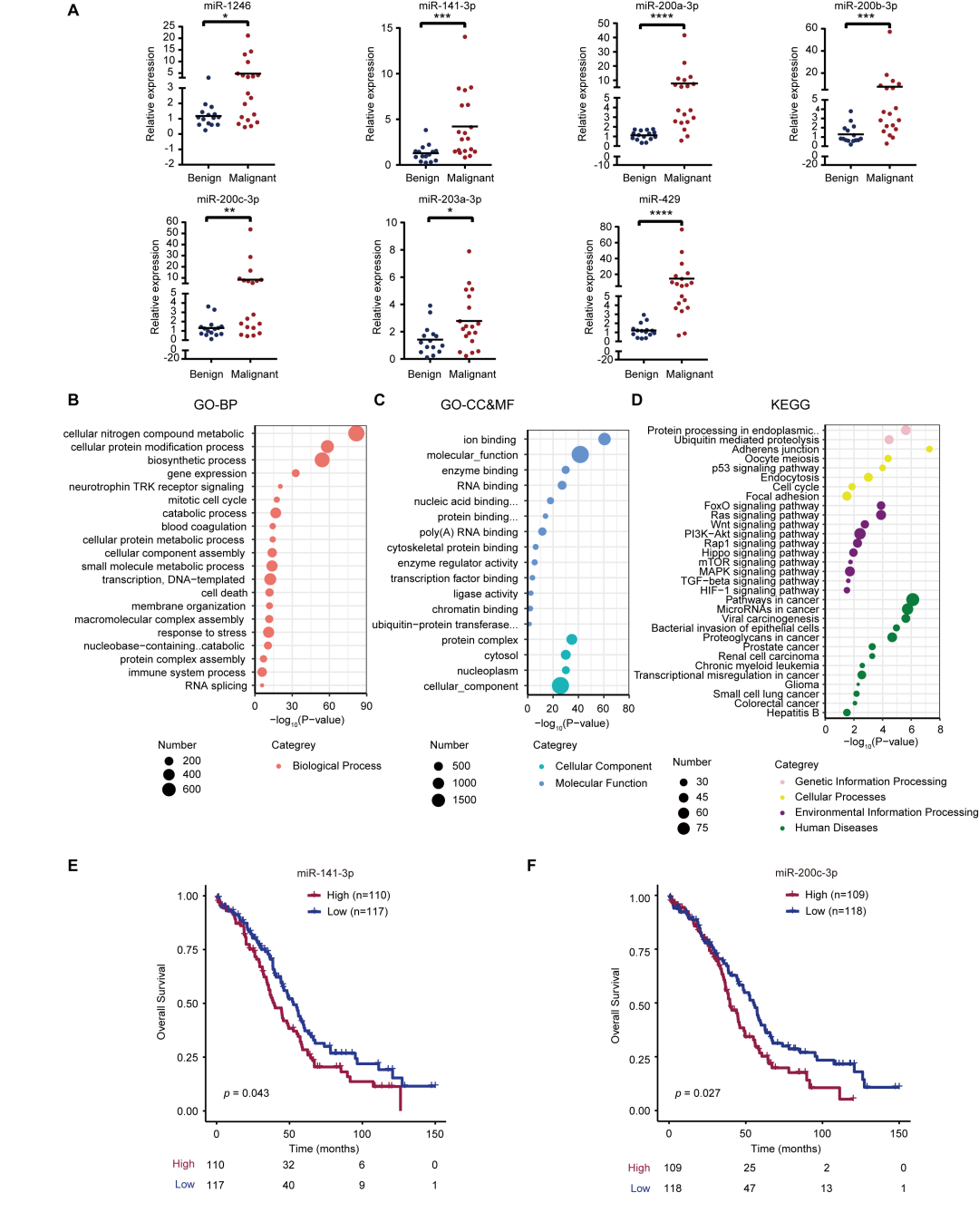
本研究采用qPCR方法验证用于建模的七个sEV miRNAs在良恶性患者间的差异表达。研究结果显示qPCR检测与小RNA测序分析变化趋势一致(图4A)。本研究分析发现多个与七个DEMs调控相关的生物学过程、细胞组成、分子功能和信号转导通路(图4B-D)。同时,本研究结果表明miR-141-3p和miR-200c-3p可以有效预测卵巢癌患者预后(图4E-F)。
图 4. sEV miRNA对信号通路和预后的影响 (A) 采用qPCR方法验证良性和卵巢癌患者间七个差异血清sEV miRNAs表达变化;(B-D) 基于DEMs的关联信号通路分析; (E) miR-141-3p生存曲线;(F) miR-200c-3p生存曲线
本研究结合手术患者良恶性和术前术后残留情况,对七个血清sEV miRNAs做了进一步比对分析。结果显示,七个sEV miRNAs在良性、恶性、术后无残留和术后残留患者组表达图谱特征存在差异(图5A-B)。恶性患者术前的sEVmiR-EOC风险评分显著高于术后无残留患者(图5C-D)。此外,配对分析结果与上述结论基本一致(图5E-F)。术前sEVmiR-EOC风险评分高低对患者无进展生存期(PFS)无显著影响(图5G)。术后sEVmiR-EOC风险评分高的患者PFS显著变差(图5H)。基于sEVmiR-EOC风险评估对卵巢癌患者进行细分结果显示,患者sEVmiR-EOC风险评分与患者PFS改善间存在显著负相关(图5I)。
图 5. sEVmiR-EOC模型预测卵巢癌患者预后 (A) 基于不同患者sEV miRNAs表达的PCA分析;(B) 基于七个sEV miRNAs的无监督聚类分析; (C) sEVmiR-EOC模型风险评估分析;(D) sEVmiR-EOC模型风险评估配对分析; (E) 术后无残留患者手术前后七个DEMs配对分析;(F) 术后有残留患者术前后七个DEMs配对分析;(G) 基于术前血清样本或 (H) 术后血清样本sEVmiR-EOC风险评估生存曲线;(H) 基于sEVmiR-EOC风险评估分布区间的生存曲线
本研究采用良性和卵巢癌患者血液样本,发现这两组人群的血清sEVs中存在七个DEMs(miR-1246、miR-141-3p、miR-200a-3p、miR-200b-3p、miR-200c-3p、miR-203a-3p 和 miR-429)。进一步研究发现,基于七个DEMs建立的sEVmiR-EOC模型可有效区分良恶性患者。另外,本研究分析卵巢癌术前和术后血样之间 sEV miR-EOC风险评估值变化,发现 sEVmiR-EOC模型可以预测卵巢癌患者的预后。本研究结果表明,血清sEV miRNA可作为卵巢癌无创诊断和预后预测的生物标志物(图6)。
图 6. sEVmiR-EOC模型用于卵巢癌诊断和预后预测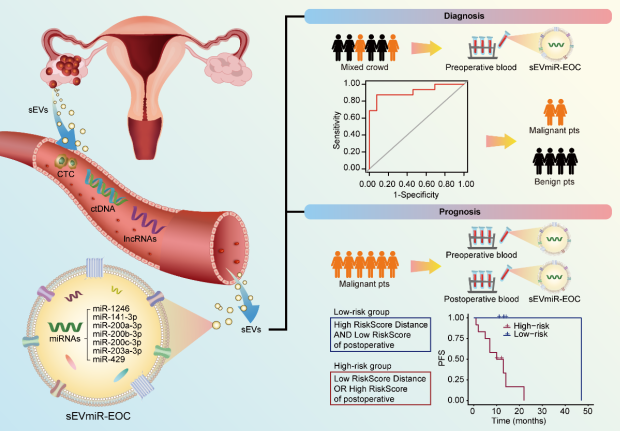
Identifying Serum Small Extracellular Vesicle MicroRNA as a Noninvasive Diagnostic and Prognostic Biomarker for Ovarian Cancer. ACS Nano 2023 Oct 10;17(19):19197-19210. doi: 10.1021/acsnano.3c05694.
